Quimica Organica
La Química Orgánica se define como la rama de la Química que estudia la estructura, comportamiento, propiedades y usos de los compuestos que contienen carbono. Esta definición excluye algunos compuestos tales como los óxidos de carbono, las sales del carbono y los cianuros y derivados, los cuales por sus características pertenecen al campo de la química inorgánica. Pero éstos, son solo unos cuantos compuestos contra los miles de compuestos que estudia la química orgánica.
A este campo de de estudio se le conoce como “química orgánica” porque durante un tiempo se creyó que éstos compuestos provenían forzosamente de organismos vivos, teoría conocida como de la “fuerza vital”. Fue hasta 1828 que el químico alemán Federico Wöhler (1800-1882) obtuvo urea H2N-CO-NH2 calentando HCNO (ácido ciánico) y NH3 (amoniaco) cuando intentaba preparar NH4CNO (cianato de amonio), con la cual se echó por tierra la teoría de la fuerza vital.
La Química Orgánica estudia aspectos tales como:
- Los componentes de los alimentos: carbohidratos, lípidos, proteínas y vitaminas.
- Industria textil
- Madera y sus derivados
- Industria farmacéutica
- Industria alimenticia
- Petroquímica
- Jabones y detergentes
- Cosmetología
Estos son solo algunos de los muchos ejemplos que podríamos citar sobre el estudio de la química orgánica.
2. Características de los compuestos del carbono
Para entender mejor las características de los compuestos orgánicos, presentamos una tabla comparativa entre las características de los compuestos orgánicos e inorgánicos.
Característica | Compuestos orgánicos | Compuestos inorgánicos |
Composición | Principalmente formados por carbono, hidrógeno, oxígeno y nitrógeno. | Formados por la mayoría de los elementos de la tabla periódica. |
Enlace | Predomina el enlace covalente. | Predomina el enlace iónico. |
Solubilidad | Soluble en solventes no polares como benceno. | Soluble en solventes polares como agua. |
Conductividad eléctrica | No la conducen cuando están disueltos. | Conducen la corriente cuando están disueltos. |
Puntos de fusión y ebullición. | Tienen bajos puntos de fusión o ebullición. | Tienen altos puntos de fusión o ebullición. |
Estabilidad | Poco estables, se descomponen fácilmente. | Son muy estables. |
Estructuras | Forman estructuras complejas de alto peso molecular. | Forman estructuras simples de bajo peso molecular. |
Velocidad de reacción | Reacciones lentas | Reacciones casi instantáneas |
Isomería | Fenómeno muy común. | Es muy raro este fenómeno |
El átomo de carbono
Siendo el átomo de carbono la base estructural de los compuestos orgánicos, es conveniente señalar algunas de sus características.
Característica |
|
Número atómico | 6 |
Configuración electrónica |
|
Nivel de energía más externo (periodo) | 2 |
Electrones de valencia | 4 |
Masa atómica promedio | 12.01 g/mol |
Propiedades físicas | Es un sólido inodoro, insípido e insoluble en agua |
El átomo de carbono forma como máximo cuatro
enlaces covalentes compartiendo electrones con otros átomos. Dos carbonos pueden compartir dos, cuatro o seis electrones.

Hibridización de orbitales.
Hibridizacion Sp3
El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):
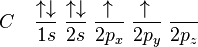
Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py)necesitarían tener dos electronorbitales p por lo consiguiente se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es excitado y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:
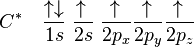
El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados (sp3: un poco de ambos orbitales):
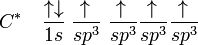
De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°.
Hibridizacion Sp2
Estos mismos átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (π).Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla solo con dos de los orbitales 2p:.surge a partir o al unirse el orbital s con orbitales p por lo consiguiente se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes.
Se define como la combinacion de un orbital S y un P, para formar 2 orbitales híbridos, con orientacion lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):

| Geometría molecular tetraédrica.- El carbono se encuentra en el centro de un tetraedro y los enlaces se dirigen hacia los vértices.
|
| Geometría triangular plana.- El carbono se encuentra en el centro de un triángulo. Se forma un doble enlace y dos enlaces sencillos. |
| Geometría lineal.- Se forman dos enlaces sencillos y uno triple.
|
Tipos de carbono
En una cadena podemos identificar cuatro tipos de carbono, de acuerdo al número de carbonos al cual esté unido el átomo en cuestión.
PRIMARIO.- Está unido a un solo átomo de carbono. | Ejemplo: CH3-CH2-CH3 | |
Los carbonos de color rojo son primarios porque están unidos a un solo carbono, el de color azul.
| ||
SECUNDARIO.- Está unido a dos átomos de carbono. | Ejemplo: CH3-CH2-CH3 | |
El carbono de color rojo es secundario porque está unido a dos átomos de carbono, los de color azul.
| ||
TERCIARIO.- Está unidos a tres átomos de carbono. | Ejemplo:
| |
El carbono de color rojo es terciario porque está unido a tres carbonos, los de color azul.
| ||
CUATERNARIO.- Está unido a 4 átomos de carbono. | Ejemplo:
| |
El carbono rojo es cuaternario porque está unido a 4 átomos de carbonos, los de color azul. | ||

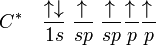





No hay comentarios:
Publicar un comentario